Communiqué de presse : L’amlitelimab de Sanofi a atteint tous les critères d’évaluation principaux et secondaires clés dans l’étude de phase 3 COAST 1 menée chez des adultes et des adolescents atteints de dermatite atopique
L’amlitelimab de Sanofi a atteint tous les critères d’évaluation principaux et secondaires clés dans l’étude de phase 3 COAST 1 menée chez des adultes et des adolescents atteints de dermatite atopique
- L’amlitelimab, administré toutes les quatre semaines ou toutes les douze semaines, a démontré une efficacité statistiquement et cliniquement significative en termes de clairance cutanée et de gravité de la maladie par rapport au placebo à la semaine 24, avec une efficacité qui augmente progressivement tout au long de la période de traitement.
- Les résultats de l’étude confirment le potentiel de l’amlitelimab en tant que premier et unique traitement de la dermatite atopique pouvant être administré seulement quatre fois par an.
- Des données supplémentaires issues de l’étude de phase 3 permettront de mieux comprendre le profil d’efficacité et de sécurité de l’amlitelimab, notamment le rôle du traitement d’entretien à long terme et le potentiel d’efficacité hors traitement dans diverses populations de patients.
Paris, le 4 septembre 2025. Les résultats positifs de l’étude mondiale de phase 3 COAST 1 (identifiant de l’étude clinique : NCT06130566) ont montré que l’amlitelimab, un anticorps monoclonal entièrement humain non déplétif des cellules T qui cible le ligand OX40 (OX40L), administré soit toutes les quatre semaines (1/x4 sem.), soit toutes les 12 semaines (1/x12 sem.), a atteint tous les critères d’évaluation principaux et secondaires clés. L’amlitelimab a démontré une amélioration statistiquement et cliniquement significative de la clairance cutanée et de la sévérité de la maladie par rapport au placebo à la semaine 24 chez les patients âgés de 12 ans et plus atteints de dermatite atopique (DA) modérée à sévère. L’amlitelimab a été bien toléré et aucun nouveau problème de sécurité d’emploi n’a été identifié dans le cadre de cette étude.
« Ces premiers résultats positifs de phase 3 de l’amlitelimab renforcent le potentiel du ciblage du ligand OX40 pour normaliser le système immunitaire hyperactif, sans déplétion des cellules T », a déclaré Houman Ashrafian, vice-président exécutif et directeur de la recherche et du développement chez Sanofi. « L’amlitelimab pourrait représenter une avancée significative dans le traitement de la dermatite atopique, avec une efficacité cliniquement significative et progressivement croissante et la possibilité d’un dosage seulement quatre fois par an. Ces données prometteuses, observées dans une population étudiée qui reflète davantage la diversité actuelle des patients, dont une proportion importante a déjà reçu des traitements de pointe, confortent notre ambition de proposer des médicaments différenciés. Nous sommes impatients de partager d’autres résultats de phase 3 du programme de développement clinique OCEANA. »
Les critères d’évaluation clés ont été mesurés à la semaine 24 chez les patients qui ont reçu l’amlitelimab 1x/4 sem ou 1x/12 sem. Pour les États-Unis et les pays de référence américains, le critère d’évaluation principal était la proportion de patients avec une échelle d'évaluation globale validée par l'investigateur pour la dermatite atopique (validated Investigator Global Assessment Scale for Atopic Dermatitis, vIGA-AD) de 0 (peau nette) ou 1 (peau presque nette) et une réduction du score initial ≥2 points. Pour l’UE, les pays de référence de l’UE et le Japon, les co-critères d’évaluation principaux comprenaient la proportion de patients avec une échelle d’évaluation globale de l’investigateur validée pour la dermatite atopique vIGA-AD de 0 (clairance complète) ou 1 (clairance presque complète) et une réduction, par rapport au score de la ligne de base, de ≥ 2 points ainsi que la proportion de patients atteignant une amélioration de 75 % ou plus du score total de l’indice de gravité et de la zone d’eczéma (EASI-75).
| Critères d’évaluation clés Proportion de patients |
Imputation des non-répondeurs* | Politique de traitement** | ||||
| 1x/4 sem. | 1x/12 sem. | Placebo | 1x/4 sem. | 1x/12 sem. | Placebo | |
| vIGA-AD 0/1 |
21,1 % Valeur p (p) < 0,01 |
22,5 % p < 0,01 |
9,2 % | 26,5 % p < 0,001 |
29,1 % p < 0,001 |
10,5 % |
| EASI-75 | 35,9 % p < 0,001 |
39,1 % p < 0,001 |
19,1 % | 46,0 % p < 0,001 |
50,3 % p < 0,001 |
27,6 % |
* Imputation des non-répondeurs : inclut les patients qui ont utilisé des médicaments de secours/interdits avant la semaine 24 et présentant des données manquantes.
** Politique de traitement : inclut les données des patients qui ont utilisé des médicaments de secours avant la semaine 24. Remarque : dans les deux analyses, imputation des non-répondeurs pour les patients qui ont utilisé des médicaments interdits et qui présentent des données manquantes.
Dans les deux groupes de traitement, une augmentation progressive de l’efficacité sans plateau a été observée pendant la période de traitement :
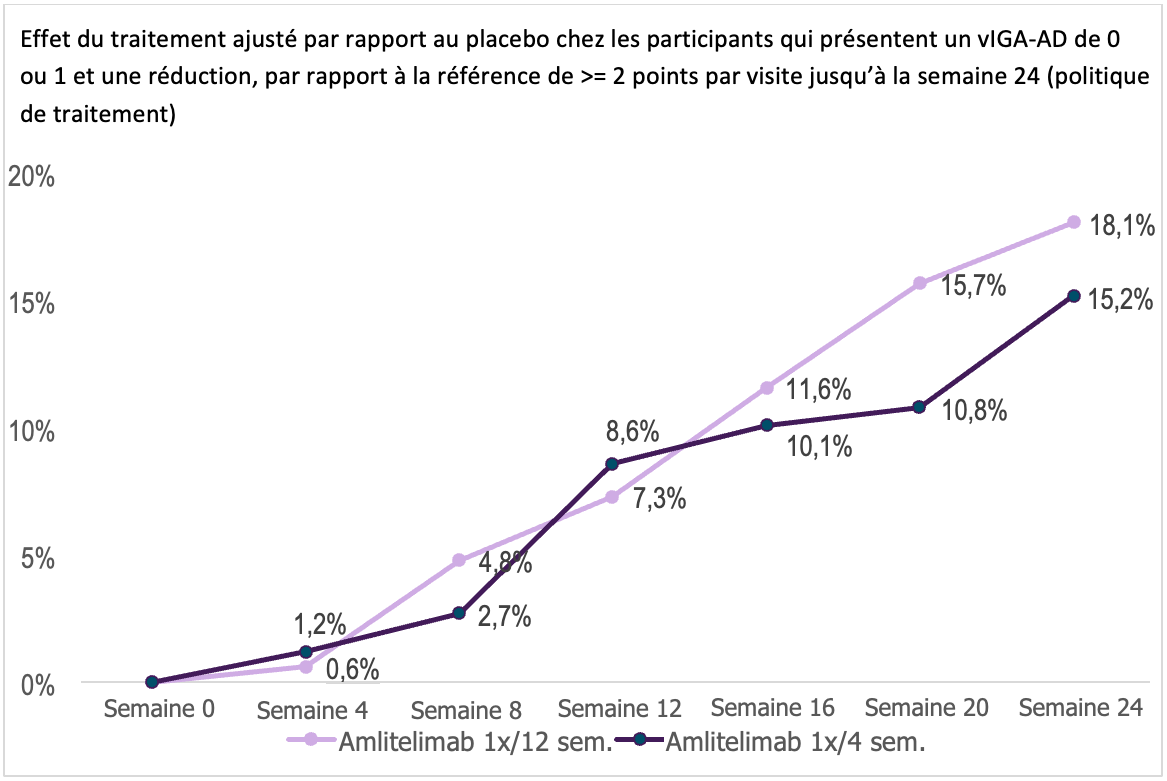
(Les effets du traitement à la semaine 24 sont modélisés et ne correspondent pas au tableau).
Les critères d’évaluation secondaires clés de l’étude ont également été atteints dans les deux groupes de dosage à la semaine 24, y compris la proportion de patients ayant obtenu un score vIGA-AD 0/1 avec seulement un érythème à peine perceptible et une réduction par rapport à la valeur initiale de ≥ 2 points, et la proportion de patients ayant obtenu une réduction de ≥ 4 points de l’échelle d’évaluation numérique du prurit maximal (Peak Pruritus-Numerical Rating Scale, PP-NRS) par rapport à la valeur initiale chez les patients ayant un PP-NRS, à la ligne de base ≥ 4.
Les événements indésirables les plus fréquents survenus au cours du traitement dans l’étude COAST 1 (≥ 5 % dans n’importe quel groupe de dosage) étaient la DA, la rhinopharyngite et l’infection des voies respiratoires supérieures. Tous étaient plus fréquents dans le groupe placebo que dans les groupes traités par amlitelimab. Les réactions au site d’injection étaient numériquement plus fréquentes dans les groupes traités par l’amlitelimab (amlitelimab combiné 2,2 %, placebo 0,7 %). Toutes étaient légères, les patients se sont rétablis et le médicament de l’étude a été poursuivi dans tous les cas. Les taux de pyrexie (1,1% dans les groupes amlitelimab combinés contre 0,7% dans le groupe placebo) et de frissons (0,4% dans les groupes amlitelimab combinés contre 0% dans le groupe placebo) étaient faibles. Dans l’ensemble, les taux d’événements indésirables survenus au cours du traitement (TEAE), d’événements indésirables graves et de TEAE ayant entraîné l’arrêt du traitement étaient similaires dans le groupe placebo et les groupes sous amlitelimab combinés.
Les résultats complets seront soumis pour présentation lors d’une prochaine conférence médicale.
Le programme de développement clinique OCEANA de l’amlitelimab dans le traitement de la DA, comprend COAST 1 et quatre autres études de phase 3 (SHORE, COAST 2, AQUA et ESTUARY) dont les résultats sont attendus d’ici 2026 et constitue la base des demandes d’autorisation potentielles auprès des autorités réglementaires mondiales.
L’amlitelimab est actuellement en cours d’investigation clinique ; ses profils de sécurité et d’efficacité n’ont été évalués par aucune autorité réglementaire.
À propos de l’étude COAST 1
COAST 1 était une étude de phase 3 randomisée, en double aveugle, contrôlée par placebo, à groupes parallèles, à 3 bras, mondiale et multicentrique, visant à évaluer l’efficacité et la sécurité d’emploi de l’amlitelimab en monothérapie par injection sous-cutanée chez 601 adultes et adolescents âgés de 12 ans et plus atteints de DA modérée à sévère. Les principaux objectifs comprenaient la mesure de l’efficacité et de la sécurité d’emploi de l’amlitelimab par rapport au placebo à la semaine 24. Dans l’étude, l’amlitelimab a été administré à une dose de 250 mg (125 mg pour les patients pesant < 40 kg) selon un schéma 1x/4 sem. ou 1x/12 sem. après une dose de charge de 500 mg (250 mg pour les patients pesant < 40 kg). L’étude a porté sur des sites situés dans 15 pays d’Amérique du Nord, d’Amérique latine, d’Europe, d’Asie-Pacifique et du Moyen-Orient, reflétant une population d’étude diversifiée.
À propos de l’amlitelimab
L’amlitelimab (SAR445229, KY1005) est un anticorps monoclonal entièrement humain, qui n’appauvrit pas les cellules T et bloque OX40L, un régulateur immunitaire clé. Grâce à son mécanisme d’action novateur, l’amlitelimab vise à normaliser le système immunitaire hyperactif sans détruire les lymphocytes T. Il pourrait devenir le premier ou le meilleur traitement de sa catégorie pour toute une série de maladies à médiation immunitaire et de troubles inflammatoires, notamment l’indication principale de la DA modérée à sévère, et potentiellement l’asthme modéré à sévère, la sclérose systémique, la maladie cœliaque et l’alopécie areata.
À propos de Sanofi
Sanofi est une entreprise biopharmaceutique qui innove en R&D et exploite l’IA à grande échelle pour améliorer la vie des gens et réaliser une croissance à long terme. Nous appliquons notre connaissance approfondie du système immunitaire pour inventer des médicaments et des vaccins qui traitent et protègent des millions de personnes dans le monde entier, avec un pipeline innovant qui pourrait bénéficier à des millions d’autres. Notre équipe est guidée par un seul objectif : nous poursuivons les miracles de la science pour améliorer la vie des gens ; cela nous inspire pour stimuler le progrès et avoir un impact positif pour nos collaborateurs et les communautés que nous servons, en s’attaquant aux défis les plus urgents de notre époque en matière sanitaire, environnementale, et sociétale.
Sanofi est cotée sur EURONEXT : SAN et NASDAQ : SNY
Relations presse
Sandrine Guendoul | +33 6 25 09 14 25 | sandrine.guendoul@sanofi.com
Evan Berland | +1 215 432 0234 | evan.berland@sanofi.com
Léo Le Bourhis | +33 6 75 06 43 81 | leo.lebourhis@sanofi.com
Victor Rouault | +33 6 70 93 71 40 | victor.rouault@sanofi.com
Timothy Gilbert | +1 516 521 2929 | timothy.gilbert@sanofi.com
Léa Ubaldi | +33 6 30 19 66 46 | lea.ubaldi@sanofi.com
Relations avec les investisseurs
Thomas Kudsk Larsen | +44 7545 513 693 | thomas.larsen@sanofi.com
Alizé Kaisserian | +33 6 47 04 12 11 | alize.kaisserian@sanofi.com
Felix Lauscher | +1 908 612 7239 | felix.lauscher@sanofi.com
Keita Browne | +1 781 249 1766 | keita.browne@sanofi.com
Nathalie Pham | +33 7 85 93 30 17 | nathalie.pham@sanofi.com
Tarik Elgoutni | +1 617 710 3587 | tarik.elgoutni@sanofi.com
Thibaud Châtelet | +33 6 80 80 89 90 | thibaud.chatelet@sanofi.com
Yun Li | +33 6 84 00 90 72 | yun.li3@sanofi.com
Déclarations prospectives de Sanofi
Ce communiqué de presse contient des déclarations prospectives au sens du Private Securities Litigation Reform Act de 1995, tel que modifié. Les déclarations prospectives ne constituent pas des faits historiques. Elles incluent des projections et estimations ainsi que les hypothèses sous-jacentes, des déclarations concernant les plans, objectifs, intentions et attentes relatifs à des résultats financiers futurs, événements, opérations, services, au développement et au potentiel de produits, ainsi que des déclarations concernant les performances futures. Les déclarations prospectives sont généralement identifiées par des termes tels que « prévoit », « anticipe », « pense », « a l’intention de », « estime », « planifie » et des expressions similaires. Bien que la direction de Sanofi considère que les attentes reflétées dans ces déclarations prospectives sont raisonnables, il est rappelé aux investisseurs que ces informations et déclarations prospectives sont soumises à divers risques et incertitudes, dont beaucoup sont difficiles à prévoir et généralement hors du contrôle de Sanofi, et qui pourraient entraîner un écart significatif entre les résultats et développements réels et ceux exprimés, sous-entendus ou projetés dans ces informations et déclarations prospectives. Ces risques et incertitudes comprennent notamment : les incertitudes inhérentes à la recherche et au développement ; les données et analyses cliniques futures, y compris post-commercialisation ; les décisions des autorités réglementaires, telles que la FDA ou l’EMA, quant à savoir si et quand elles approuveront toute demande d’autorisation concernant un médicament, dispositif ou produit biologique, ainsi que leurs décisions relatives à l’étiquetage ou à d’autres sujets pouvant influencer la disponibilité ou le potentiel commercial de ces candidats produits ; le fait que les candidats produits, s’ils sont approuvés, puissent ne pas rencontrer de succès commercial ; l’approbation future et le succès commercial d’alternatives thérapeutiques ; la capacité de Sanofi à tirer parti d’opportunités de croissance externe, à mener à bien les transactions associées et/ou à obtenir les autorisations réglementaires nécessaires ; les risques liés à la propriété intellectuelle et à tout contentieux en cours ou futur ainsi que leur issue éventuelle ; les tendances en matière de taux de change et de taux d’intérêt ; la volatilité des conditions économiques et de marché ; les initiatives de maîtrise des coûts et leurs évolutions ultérieures ; ainsi que l’impact que des crises mondiales pourraient avoir sur nous, nos clients, fournisseurs, prestataires et autres partenaires commerciaux, sur leur situation financière, ainsi que sur nos collaborateurs et sur l’économie mondiale dans son ensemble. Les risques et incertitudes incluent également ceux évoqués ou identifiés dans les documents publics déposés par Sanofi auprès de la SEC et de l’AMF, y compris ceux figurant à la rubrique « Facteurs de risque » et dans la section « Déclarations prospectives » du Document 20-F de Sanofi pour l’exercice clos le 31 décembre 2024. Sauf dans les cas où la législation applicable l’exige, Sanofi n’assume aucune obligation de mettre à jour ou de réviser les informations ou déclarations prospectives.
Toutes les marques citées dans le présent communiqué de presse sont la propriété du groupe Sanofi.
Pièce jointe

Legal Disclaimer:
EIN Presswire provides this news content "as is" without warranty of any kind. We do not accept any responsibility or liability for the accuracy, content, images, videos, licenses, completeness, legality, or reliability of the information contained in this article. If you have any complaints or copyright issues related to this article, kindly contact the author above.
